Decisão da FDA sobre o medicamento experimental para a doença de Alzheimer prevista para esta semana
O lecanemab - um dos primeiros medicamentos experimentais contra a demência que parece retardar a progressão do declínio cognitivo - demonstrou "potencial" como tratamento da doença de Alzheimer, de acordo com os resultados dos ensaios de Fase 3, mas suscitou preocupações de segurança devido à sua associação com determinados acontecimentos adversos graves, incluindo inchaço e hemorragia cerebral.
Em julho, a FDA aceitou o pedido de licença biológica da Eisai para o lecanemab ao abrigo da via de aprovação acelerada e concedeu ao medicamento uma revisão prioritária, segundo a empresa. O programa de aprovação acelerada permite a aprovação antecipada de medicamentos que tratam doenças graves e "preenchem uma necessidade médica não satisfeita", enquanto os medicamentos continuam a ser estudados em ensaios maiores e mais longos.
A FDA deverá decidir se concede a aprovação acelerada ao lecanemab até 6 de janeiro, confirmou Libby Holman, porta-voz da Eisai, à CNN.
"Se o lecanemab for aprovado pela FDA ao abrigo da Via de Aprovação Acelerada, a Eisai fará tudo o que estiver ao seu alcance para disponibilizar o lecanemab o mais rapidamente possível", escreveu Holman numa mensagem de correio eletrónico. "A Eisai pretende apresentar um pedido de licença biológica suplementar para aprovação tradicional nos EUA em breve e apresentar pedidos de autorização de comercialização no Japão e na Europa até o final do ano fiscal de 2022 da Eisai, que termina em 31 de março de 2023."
A Associação de Alzheimer também espera que o FDA tome medidas até 6 de janeiro, disse Maria Carrillo, diretora científica do grupo, em um comunicado.
"Acreditamos, com base na totalidade dos dados positivos dos ensaios clínicos deste tratamento, que a FDA deve aprová-lo. Os resultados publicados e revistos por pares mostram que o lecanemab dará aos doentes nas fases iniciais da doença de Alzheimer mais tempo para participarem na vida quotidiana e viverem de forma independente. Pode significar muitos meses mais de reconhecimento do cônjuge, dos filhos e dos netos", afirmou Carrillo na declaração.
Carrillo acrescentou que a Associação de Alzheimer espera que os Centros de Serviços Medicare e Medicaid "avancem rapidamente" para cobrir o medicamento e "revejam a sua decisão de cobertura que atualmente bloqueia o acesso a este tratamento". O CMS determina se deve cobrir as terapias aprovadas pela FDA com base no facto de as considerar seguras e eficazes.
"A Alzheimer's Association apresentou um pedido formal à CMS para que esta forneça cobertura total e sem restrições aos tratamentos para a doença de Alzheimer aprovados pela FDA", afirmou Carrillo.
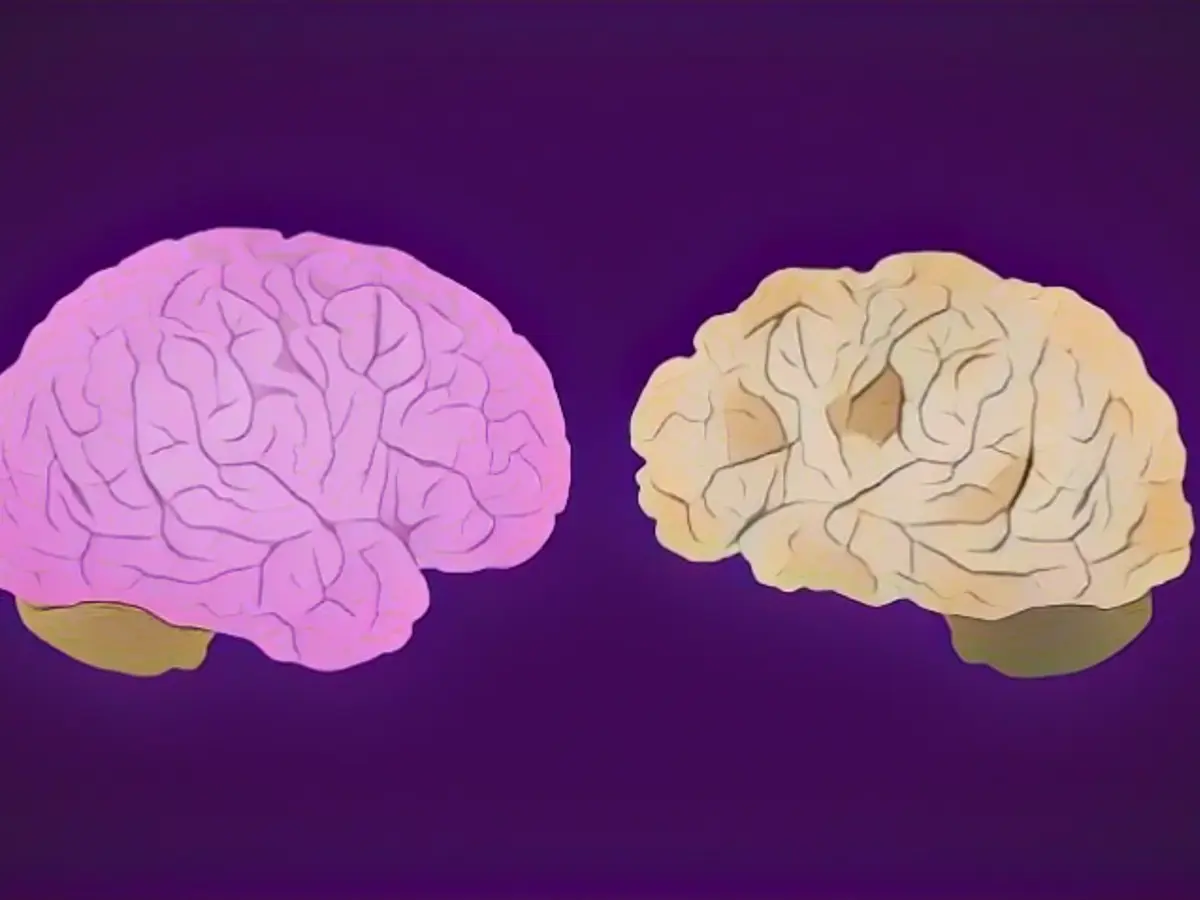
O lecanemab, um anticorpo monoclonal, não é uma cura, mas actua ligando-se à beta amiloide, uma caraterística da doença de Alzheimer.
No final de novembro, os resultados de um ensaio clínico de Fase 3 de 18 meses publicado no The New England Journal of Medicine mostraram que o lecanemab "reduziu os marcadores de amiloide na doença de Alzheimer inicial e resultou num declínio moderadamente menor nas medidas de cognição e função do que o placebo aos 18 meses, mas foi associado a eventos adversos".
Os resultados mostraram também que cerca de 6,9% dos participantes no ensaio que receberam lecanemab, sob a forma de perfusão intravenosa, interromperam o ensaio devido a acontecimentos adversos, em comparação com 2,9% dos que receberam um placebo. Globalmente, registaram-se acontecimentos adversos graves em 14% do grupo do lecanemab e em 11,3% do grupo do placebo.
Os acontecimentos adversos mais comuns no grupo do lecanemab foram reacções às infusões intravenosas e anomalias nas suas ressonâncias magnéticas, tais como inchaço cerebral e hemorragia, designadas por anomalias de imagem relacionadas com a amiloide, ou ARIA, que podem ser fatais.
Algumas pessoas que sofrem de ARIA podem não apresentar sintomas, mas podem ocasionalmente levar à hospitalização ou a uma incapacidade duradoura. E a frequência de ARIA parece ser maior em pessoas que têm um gene chamado APOE4, que pode aumentar o risco de doença de Alzheimer e outras demências. As ARIA "eram numericamente menos comuns" entre os não portadores do APOE4.
Os resultados do ensaio também mostraram que cerca de 0,7% dos participantes no grupo do lecanemab e 0,8% dos participantes no grupo do placebo morreram, o que corresponde a seis mortes no grupo do lecanemab e sete no grupo do placebo.
Mesmo que a FDA conceda a aprovação acelerada do medicamento, este continuará a ser estudado em ensaios mais robustos. E se esses ensaios confirmarem que o medicamento proporciona um benefício clínico, a FDA poderá conceder a aprovação tradicional. Mas se o ensaio de confirmação não mostrar benefícios, a FDA tem procedimentos regulamentares que podem levar a retirar o medicamento do mercado.
Receba o boletim informativo semanal da CNN Health
Inscreva-seaqui para receber The Results Are In with Dr. Sanjay Guptae todas asterças-feiras da equipa da CNN Health.
"Se e quando este medicamento for aprovado pela FDA, os clínicos levarão algum tempo a conseguir analisar a forma como este medicamento pode ou não ser eficaz nos seus próprios doentes", especialmente porque os portadores do gene APOE4 podem correr um maior risco de efeitos secundários, disse em novembro o Dr. Richard Isaacson, diretor da Clínica de Prevenção da Doença de Alzheimer no Centro de Saúde Cerebral da Faculdade de Medicina Schmidt da Florida Atlantic University, que não está envolvido no estudo do lecanemab ou no seu desenvolvimento.
Mais de 300 tratamentos para a doença de Alzheimer estão a ser objeto de ensaios clínicos, de acordo com a Associação de Alzheimer. A doença de Alzheimer foi documentada pela primeira vez em 1906, quando o Dr. Alois Alzheimer descobriu alterações no tecido cerebral de uma mulher que apresentava perda de memória, problemas de linguagem e comportamentos imprevisíveis.
Esta doença debilitante afecta mais de 6 milhões de adultos nos Estados Unidos.
Leia também:
- 80 por cento dos jovens alemães comem de forma sustentável
- Corona ou epidemia de gripe? Estes agentes patogénicos estão a fazer-nos tossir e fungar neste momento
- Emil tinha 16 anos quando morreu - a sua família fala do seu suicídio para ajudar os outros
- Como manter o corpo em forma para o inverno
Fonte: edition.cnn.com