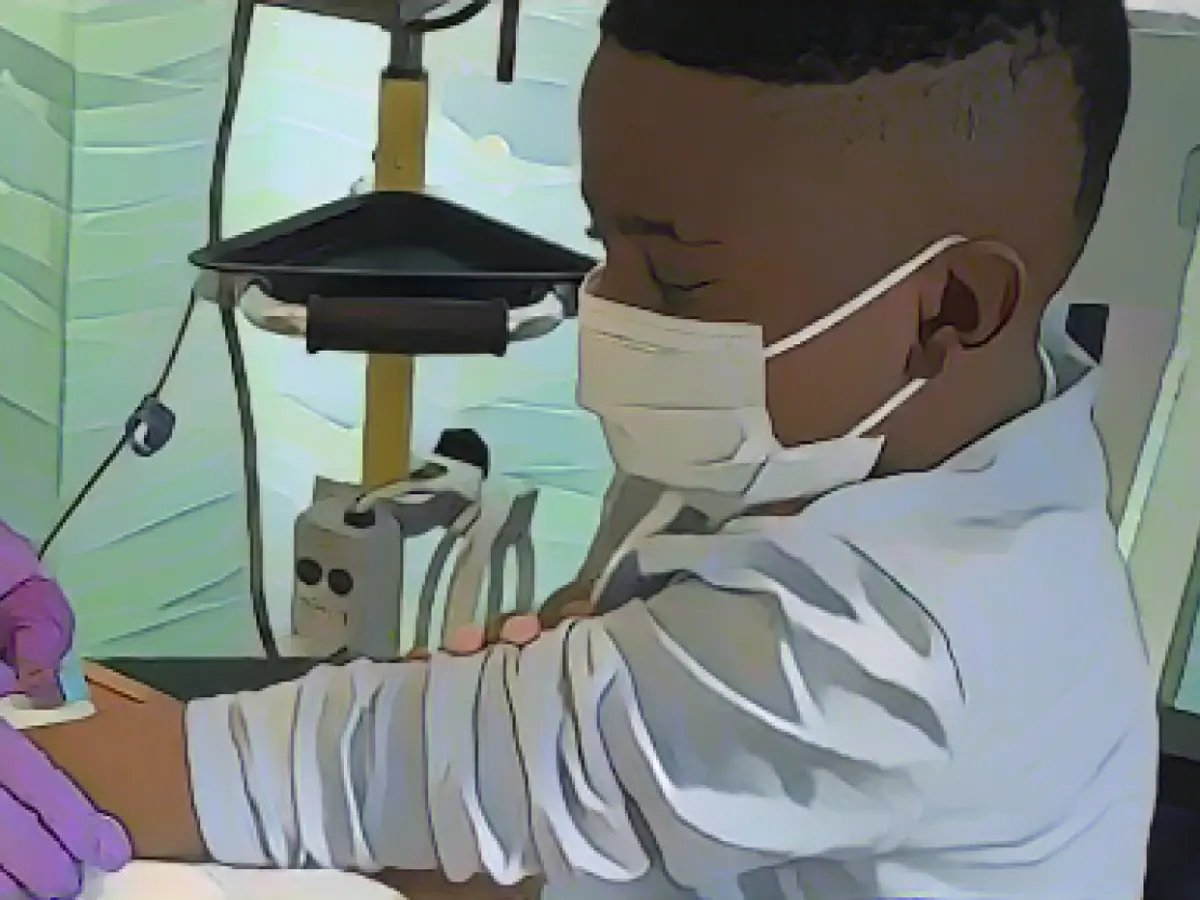
Prima di sottoporsi a un trattamento sperimentale potenzialmente in grado di cambiare la vita all'età di 13 anni, Johnny Lubin ricorda di aver avuto una preoccupazione principale. - La FDA dovrebbe approvare il primo trattamento di editing genico CRISPR, portando speranza a migliaia di persone affette da malattia falciforme
"Mi preoccupavo di poter ottenere, tipo, dei superpoteri", ha detto Johnny, che ora ha 15 anni e vive a Trumbull, nel Connecticut, a circa 60 miglia a nord di New York City.
Johnny, uno dei circa 100.000 malati di falce negli Stati Uniti, è stato anche uno dei primi al mondo a provare un nuovo tipo di medicina, che utilizza uno strumento di editing genetico chiamato CRISPR per offrire una potenziale cura.
Questo trattamento, noto come exa-cel e prodotto da Vertex Pharmaceuticals e Crispr Therapeutics, dovrebbe essere approvato oggi dalla Food and Drug Administration statunitense.
Per molti nella comunità delle cellule falciformi, si tratta di un traguardo atteso da tempo. La malattia colpisce prevalentemente gli afroamericani, secondo i Centri statunitensi per il controllo e la prevenzione delle malattie (Centers for Disease Control and Prevention), e per molto tempo è stata considerata trascurata dall 'industria farmaceutica. Si ritiene che circa 20.000 persone negli Stati Uniti siano affette da una forma sufficientemente grave della malattia da poter beneficiare di un trattamento come questo.
La prima "malattia molecolare
Le basi della falcemia sono state comprese per quasi tre quarti di secolo; nel 1949, il chimico Linus Pauling pubblicò sulla rivista Science un articolo in cui descriveva come la proteina che trasporta l'ossigeno, l'emoglobina, fosse diversa nelle persone affette da falce, dichiarando la malattia la prima "malattia molecolare". Questo avveniva quattro anni prima che venisse proposta la famosa struttura a doppia elica del DNA.
"Lo stavamo aspettando da quando è stato scoperto il DNA", ha detto il dottor Lewis Hsu, responsabile medico della Sickle Cell Disease Association of America e medico che cura i bambini affetti da falce. "È stato un lungo, lungo periodo di tempo".
La falcemia è causata da una mutazione genetica che porta i globuli rossi, che contengono emoglobina e trasportano l'ossigeno nel corpo, a essere deformati, come mezzelune o falci. Queste cellule deformate possono rimanere bloccate nei vasi sanguigni, causando danni agli organi e, caratteristica della falcemia, terribili attacchi di dolore che possono durare giorni, chiamati crisi di dolore.
"Era difficile per me fare cose come divertirmi e altro, perché dovevo sempre preoccuparmi di avere una crisi di dolore", racconta Johnny. Il dolore "era per lo più nella parte bassa della schiena, ed era sempre come un dolore martellante... Faceva molto male".
Finora, l'unica speranza di cura per le persone affette da falcemia era il trapianto di midollo osseo, o di cellule staminali. Ma Johnny, come oltre l'80% dei pazienti affetti da falce, non è riuscito a trovare un donatore compatibile.
Per i primi 13 anni della sua vita, Johnny è stato ricoverato ogni pochi mesi a causa di crisi di dolore e altre complicazioni della malattia. I suoi genitori erano costretti a fare scorta di farmaci antidolorifici oppioidi e ad avere sempre con sé una "borsa" in caso di necessità di andare in ospedale con poco preavviso.
Ma dall'ottobre 2021, quando Johnny ha ricevuto un'infusione unica di cellule modificate dal suo stesso gene, non ha più avuto crisi.
"È stato come un bambino normale", ha detto la madre di Johnny, Fabienne Desir. "Per noi è un cambiamento di vita".
Un nuovo strumento per modificare i geni
CRISPR è una tecnica di editing genico che consente agli scienziati di effettuare tagli precisi nel DNA. Il primo articolo scientifico su di essa è stato pubblicato nel 2012 e il suo sviluppo - ad opera di Jennifer Doudna ed Emmanuelle Charpentier - ha vinto il premio Nobel per la chimica solo otto anni dopo.
Per la falcemia, le cellule dei pazienti vengono rimosse dal corpo e il CRISPR viene utilizzato per apportare una modifica che riattiva la produzione di emoglobina fetale, una forma della proteina che i bambini producono nel grembo materno. Una volta che le cellule modificate vengono restituite, l'emoglobina fetale può compensare l'emoglobina mutata che causa la falce, ha spiegato la dottoressa Monica Bhatia, responsabile del trapianto di cellule staminali pediatriche presso il NewYork-Presbyterian/Columbia University Irving Medical Center, che ha contribuito a gestire la sperimentazione a cui ha partecipato Johnny.
"Sappiamo che l'emoglobina fetale ha una maggiore capacità di trasportare ossigeno rispetto all'emoglobina degli adulti o all'emoglobina falciforme", ha detto Bhatia.
La produzione di emoglobina fetale insieme all'emoglobina falciforme rende il paziente simile a chi ha il tratto falciforme, ha spiegato Bhatia; ciò avviene quando una persona eredita un gene falciforme e un gene normale e "non ha nessuna delle complicazioni della malattia", ha detto. "È più che sufficiente".
In effetti, il dottor David Altshuler, responsabile scientifico dell'azienda farmaceutica Vertex, ha sottolineato che alcune persone presentano naturalmente mutazioni genetiche che mantengono alta l'emoglobina fetale, "e non hanno sintomi, anche se hanno la malattia".
"Quindi si trattava di un approccio fisiologico e dimostrato che avrebbe funzionato se si fosse potuto attivare l'emoglobina fetale", ha detto.
I risultati degli studi clinici, compresi quelli di Johnny, lo confermano. Nei dati citati dalla FDA in vista di una riunione del comitato consultivo sulla terapia che si terrà a ottobre, 29 pazienti su 30 hanno raggiunto l'obiettivo principale dello studio: l'assenza di crisi di dolore per almeno 12 mesi dopo il trattamento. Il periodo più lungo senza crisi è stato di 45,5 mesi, quasi quattro anni, e i ricercatori continueranno a seguire i pazienti.
La speranza è che gli effetti possano durare tutta la vita.
"Non abbiamo dati a lungo termine come per il trapianto di cellule staminali", ha detto Bhatia. "Ma la speranza è che sia paragonabile a un trapianto e che sia duraturo".
Il trattamento CRISPR, chiamato Casgevy in altri Paesi dove è già stato approvato, non è l'unico all'orizzonte a breve termine per le cellule falciformi; un altro, che utilizza una tecnologia diversa, è in ritardo di poche settimane, con una potenziale approvazione entro il 20 dicembre.
Prodotto da Bluebird Bio, il secondo approccio prevede una tecnologia più vecchia, che utilizza un virus per fornire una copia sana del gene che produce l'emoglobina adulta per sostituire quella che produce la forma malata. Inoltre, prevede la rimozione delle cellule del paziente dal suo corpo, per poi restituirle. I risultati sono altrettanto incoraggianti.
"Entrambi apportano enormi benefici ai pazienti", ha dichiarato Andrew Obenshain, CEO di Bluebird.
Un prezzo di oltre un milione di dollari
Tuttavia, la questione chiave è se le persone saranno in grado di permettersi e di accedere a questi trattamenti. I trattamenti genetici una tantum hanno in genere un prezzo superiore a 1 milione di dollari l'uno e richiedono l'infrastruttura di grandi sistemi medici.
"Non so se saranno coperti e pagati", ha detto Hsu. Inoltre, i tipi di centri medici accademici che potrebbero offrire il trattamento sono in genere nelle grandi città.
"Io sono in Illinois, e sono concentrati a Chicago, il che lascia il resto dello Stato praticamente spoglio, e quindi le persone dovrebbero percorrere una distanza molto lunga per poterlo raggiungere", ha detto. "E poi in alcuni Stati non c'è nulla".
E il trattamento non è semplice: richiede molte cure aggiuntive che aumentano i costi. In genere i pazienti rimangono in ospedale per circa un mese per prepararsi alla re-infusione di cellule modificate geneticamente, sottoponendosi prima al cosiddetto "condizionamento": diversi giorni di chemioterapia per eliminare il midollo osseo, che produce cellule del sangue e piastrine, in modo da essere pronti a ricevere le nuove cellule.
Poi, "ci vuole un periodo di tempo perché queste cellule si insedino nel midollo osseo e crescano", ha detto Bhatia.
Il periodo intorno all'infusione può essere molto difficile per i pazienti e le loro famiglie; la mamma di Johnny ha descritto come "l'intero tratto gastrointestinale di Johnny era infiammato; non riusciva a deglutire. È stato davvero doloroso. È stato difficile da guardare".
E il condizionamento chemioterapico comporta dei rischi, tra cui la possibilità di infertilità, ha osservato Hsu. Ha sottolineato che esistono metodi per cercare di preservare la fertilità prima del trattamento, ma la copertura può variare anche a seconda dello Stato. Inoltre, secondo l'associazione Sick Cells, più della metà dei malati di falce negli Stati Uniti dipende da Medicaid come assicurazione primaria.
Il trattamento condizionante comporta anche un potenziale rischio di cancro; due pazienti nelle prime fasi della sperimentazione di Bluebird sono morti dopo aver sviluppato una leucemia, che si è scoperto non essere correlata alla terapia genica in sé ma potenzialmente alla chemioterapia necessaria per prepararla.
Altshuler di Vertex ha detto che la sua azienda sta lavorando per migliorare il processo di condizionamento per renderlo più delicato, per "creare l'opportunità per le nuove cellule di entrare senza altri danni al corpo", anche se ha sottolineato che si tratta ancora di una fase di ricerca.
Gli scienziati sono anche attenti ai potenziali effetti fuori bersaglio dell'approccio di editing genetico CRISPR - il che significa che il DNA potrebbe essere tagliato in un punto non previsto - e la FDA ha convocato una riunione di un'intera giornata in ottobre per valutare tali rischi. Molti esperti hanno espresso la convinzione che tali rischi siano "relativamente modesti".
Per Altshuler, l'aspetto più importante di una potenziale approvazione di exa-cel è che si tratta di un progresso per la malattia falciforme, non che sia la prima terapia CRISPR.
"Non si tratta di uno strumento, ma della malattia", ha detto Altshuler. "Una volta trovata la via d'accesso, e ora che abbiamo dimostrato che è possibile trattare questa malattia in modo molto efficace se si riesce ad aumentare l'emoglobina fetale, ci dedicheremo a questo".
L'azienda è nelle fasi iniziali della ricerca su come ottenere un aumento dell'emoglobina fetale utilizzando una pillola, in modo che i pazienti non debbano sottoporsi al processo di condizionamento e di editing genico, ha detto Altshuler.
Ricevi la newsletter settimanale della CNN Health
Iscriviti qui per ricevere ogni martedìThe Results Are In con il Dr. Sanjay Gupta dal team della CNN Health.
Altshuler ha sottolineato che è ancora molto presto, ma ha detto che questo tipo di approccio potrebbe essere la risposta alla domanda "molto valida" di "come aiuteremo le persone in tutto il mondo con questa terapia?".
La maggior parte dei pazienti affetti da falce vive in Africa e in India, e Obenshain di Bluebird ha detto che l'azienda non ha in programma di introdurre "questa versione" della sua terapia genica in questi Paesi, perché è troppo costosa da produrre.
"In pratica, per ogni paziente produciamo un lotto di farmaco", ha detto Obenshain.
Per Johnny e per la sua famiglia, gli effetti del trattamento sono stati così trasformativi che ora festeggiano il giorno in cui ha ricevuto l'infusione di cellule modificate geneticamente come il suo secondo compleanno. Può nuotare - un'attività che in precedenza avrebbe scatenato una crisi di dolore - senza paura e ha trascorso tutta l'estate scorsa in piscina, dice la sua famiglia.
E sebbene non abbia ottenuto i superpoteri di cui si preoccupava, ha ottenuto qualcosa di potenzialmente ancora migliore: la possibilità di essere un bambino normale.
"Sto iniziando a insegnargli a guidare", ha detto il padre di Johnny, JR Lubin. "Così stiamo entrando nella normale preoccupazione di crescere un adolescente".

Leggi anche:
- L'80% dei giovani tedeschi mangia in modo sostenibile
- Corona o epidemia di influenza? Questi agenti patogeni ci stanno facendo tossire e annusare in questo momento
- Emil aveva 16 anni quando è morto: la sua famiglia parla del suo suicidio per aiutare gli altri
- Arriva l'ondata di influenza!
Fonte: edition.cnn.com