Wissenschaftler sagen, dass die Wiederbelebung ausgestorbener Moleküle von Neandertalern und Wollmammuts Hoffnung im Kampf gegen Superbugs geben könnte
Die Dringlichkeit, mögliche Kandidaten zu identifizieren, war noch nie so groß wie heute, da die Weltbevölkerung jedes Jahr fast 5 Millionen Todesfälle zu beklagen hat, die auf mikrobielle Resistenzen zurückzuführen sind, so die Weltgesundheitsorganisation.
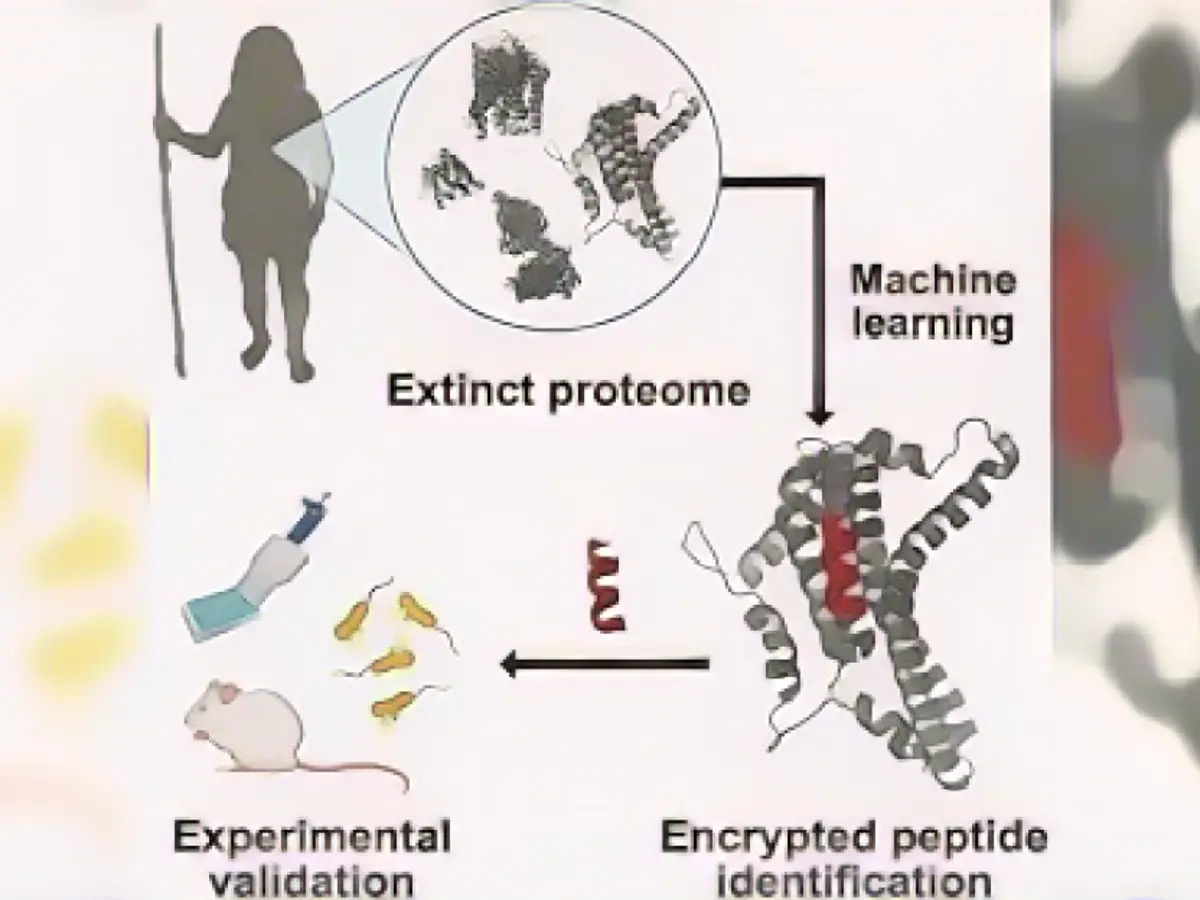
Ein Forscherteam unter der Leitung des Biotechnik-Pioniers César de la Fuente nutzt auf künstlicher Intelligenz basierende Berechnungsmethoden, um genetische Informationen von ausgestorbenen menschlichen Verwandten wie dem Neandertaler und längst ausgestorbenen Eiszeittieren wie dem Wollhaarmammut und dem Riesenfaultier zu analysieren.
Die Wissenschaftler sagen, dass einige dieser kleinen Protein- oder Peptidmoleküle, die sie identifiziert haben, bakterienbekämpfende Kräfte haben, die neue Medikamente zur Bekämpfung von Infektionen beim Menschen inspirieren könnten. Die innovative Arbeit eröffnet auch eine völlig neue Denkweise bei der Entdeckung von Medikamenten.
"Sie hat uns in die Lage versetzt, neue Sequenzen und neue Arten von Molekülen zu entdecken, die wir bisher in lebenden Organismen nicht gefunden haben, und damit die Art und Weise zu erweitern, wie wir über die molekulare Vielfalt denken", sagte de la Fuente, Assistenzprofessor an der Universität von Pennsylvania, wo er die Gruppe für Maschinenbiologie leitet. "Heutige Bakterien sind noch nie mit diesen Molekülen in Berührung gekommen, so dass sie uns eine bessere Möglichkeit bieten, die Krankheitserreger zu bekämpfen, die heute problematisch sind.
Der Ansatz mag aus der Luft gegriffen erscheinen, aber Experten sind der Meinung, dass neue Wege zur Lösung des Problems der Antibiotikaresistenz gegen bestehende Medikamente - ein tödliches und dringendes Problem für die globale Gesundheit - dringend erforderlich sind.
"Die Welt steht vor einer Antibiotikaresistenzkrise. Meiner Ansicht nach ist ein Ansatz zu Lande, zu Wasser und in der Luft erforderlich, um das Problem zu lösen - und wenn wir in die Vergangenheit gehen müssen, um potenzielle Lösungen für die Zukunft zu finden, bin ich dafür", sagte Michael Mahan, Professor in der Abteilung für Molekular-, Zell- und Entwicklungsbiologie an der University of California, Santa Barbara. Er war nicht an der Forschung beteiligt.

Antibiotika und woher ihre Alternativen kommen könnten
Die meisten Antibiotika stammen von Bakterien und Pilzen und wurden durch das Screening von Mikroorganismen entdeckt, die im Boden leben. In den letzten Jahrzehnten sind die Krankheitserreger jedoch gegen viele dieser Medikamente resistent geworden, weil sie übermäßig eingesetzt werden.
Wissenschaftler, die sich im weltweiten Kampf gegen Superbugs engagieren, erforschen verschiedene potenzielle Waffen, darunter Phagen oder Viren, die von der Natur geschaffen wurden, um Bakterien zu fressen.
Ein weiterer spannender Forschungszweig sind antimikrobielle Peptide (AMPs), d. h. Moleküle zur Infektionsbekämpfung, die von vielen verschiedenen Organismen - Bakterien, Pilzen, Pflanzen und Tieren, einschließlich des Menschen - produziert werden. AMPs haben ein breites Spektrum an antimikrobiellen Eigenschaften gegen verschiedene Krankheitserreger wie Viren, Bakterien, Hefen und Pilze, so Mahan.
Während die meisten herkömmlichen Antibiotika auf ein einziges Ziel in einer Zelle abzielen, binden antimikrobielle Peptide an die Bakterienmembran und stören sie an vielen Stellen, fügte er hinzu. Dies ist ein komplizierterer Mechanismus, der eine Resistenz gegen das Medikament unwahrscheinlicher macht, aber aufgrund des Potenzials der Moleküle, die Zellmembranen zu stören, kann dies auch zu einer erhöhten Toxizität führen, so Mahan.
Es gibt eine Handvoll Antibiotika auf Peptidbasis, die klinisch eingesetzt werden, wie z. B. Colistin, das aus einem AMP auf Bakterienbasis hergestellt wird. Es wird als letztes Mittel zur Behandlung bestimmter bakterieller Infektionen eingesetzt, da es toxisch sein kann, so Mahan. Ein menschliches AMP, bekannt als LL-37, hat ebenfalls Potenzial gezeigt.
Andere vielversprechende AMPs wurden an unerwarteten Orten gefunden: in Kiefernnadeln und im Blut des Komodowarans.
Ein "Jurassic Park"-Moment
De la Fuente hatte in den letzten zehn Jahren Berechnungsmethoden eingesetzt, um das Potenzial einer breiten Palette von Peptiden als Alternative zu Antibiotika zu bewerten. Die Idee, ausgestorbene Moleküle zu untersuchen, kam bei einem Brainstorming im Labor auf, als der Blockbuster "Jurassic Park" erwähnt wurde.
"Die Idee (in dem Film) war, ganze Organismen wieder auferstehen zu lassen, und offensichtlich hatten sie eine Menge Probleme", sagte er. Sein Team begann, über eine praktikablere Idee nachzudenken: "Warum nicht Moleküle aus der Vergangenheit zurückbringen?"
Dank der Fortschritte bei der Gewinnung alter DNA aus Fossilien sind jetzt detaillierte Bibliotheken mit genetischen Informationen über ausgestorbene menschliche Verwandte und lange verschollene Tiere öffentlich zugänglich.
Um bisher unbekannte Peptide zu finden, trainierte das Forschungsteam einen KI-Algorithmus, um fragmentierte Stellen in menschlichen Proteinen zu erkennen, die eine antimikrobielle Wirkung haben könnten. Die Wissenschaftler wendeten den Algorithmus dann auf öffentlich zugängliche Proteinsequenzen des modernen Menschen (Homo sapiens), des Neandertalers (Homo neanderthalensis) und des Denisovans an, einer anderen archaischen Menschenart, die eng mit dem Neandertaler verwandt ist.
Die Forscher nutzten dann die Eigenschaften bereits beschriebener antimikrobieller Peptide, um vorherzusagen, welche der neu identifizierten antiken Peptide das größte Potenzial zur Abtötung von Bakterien haben.

Anschließend synthetisierten und testeten die Forscher 69 der vielversprechendsten Peptide, um festzustellen, ob sie Bakterien in Petrischalen abtöten können. Das Team wählte die sechs wirksamsten aus - vier von Homo sapiens, eines von Homo neanderthalensis und eines von Denisovans - und verabreichte sie Mäusen, die mit dem Bakterium Acinetobacter baumannii infiziert waren, einer häufigen Ursache von Krankenhausinfektionen beim Menschen.
"Ich glaube, einer der aufregendsten Momente war, als wir die Moleküle im Labor mit Hilfe der Chemie wieder zum Leben erweckten und sie dann zum ersten Mal zum Leben erweckten. Aus wissenschaftlicher Sicht war es wirklich cool, diesen Moment zu erleben", sagte de la Fuente über die Forschungsarbeit, die im August in der Fachzeitschrift Cell Host & Microbe veröffentlicht wurde.
Bei infizierten Mäusen, die einen Hautabszess entwickelten, töteten die Peptide die Bakterien aktiv ab; bei Mäusen, die eine Infektion des Oberschenkels hatten, war die Behandlung weniger wirksam, stoppte aber immer noch das Wachstum der Bakterien.
"Das beste (Peptid) war das so genannte Neanderthalien 1, das von Neandertalern stammt. Und das war dasjenige, das im Mausmodell am wirksamsten war", sagte de la Fuente.
Er gab zu bedenken, dass keines der Peptide einsatzbereite Antibiotika" seien und noch viel Optimierungsarbeit erfordern würden. Wichtiger seien jedoch die Rahmenbedingungen und Instrumente, die sein Team entwickelt hat, um vielversprechende antimikrobielle Moleküle aus der Vergangenheit zu identifizieren.
In Forschungsarbeiten, die voraussichtlich nächstes Jahr veröffentlicht werden, haben de la Fuente und seine Kollegen ein neues Deep-Learning-Modell entwickelt, um das zu erforschen, was er als "Extinctom" bezeichnet - die Proteinsequenzen von 208 ausgestorbenen Organismen, für die detaillierte genetische Informationen verfügbar sind.
Das Team fand mehr als 11.000 bisher unbekannte potenzielle antimikrobielle Peptide, die nur bei ausgestorbenen Organismen vorkommen, und synthetisierte vielversprechende Kandidaten aus dem sibirischen Wollmammut, der Stellerschen Seekuh (einem Meeressäugetier, das im 18. Jahrhundert durch die arktische Jagd ausgerottet wurde), dem drei Meter langen Darwin-Faultier (Mylodon darwinii) und dem irischen Riesenelch (Megaloceros giganteus). Er sagte, dass die entdeckten Peptide bei Mäusen eine "ausgezeichnete anti-infektiöse Aktivität" zeigten.
"Die molekulare De-Extinktion bietet eine einzigartige Möglichkeit, Antibiotikaresistenzen zu bekämpfen, indem die Kraft von Molekülen aus der Vergangenheit wiederbelebt und angezapft wird", sagte er.
Ein verrückter, aber lohnender Ansatz
Dr. Dmitry Ghilarov, Gruppenleiter am John Innes Centre im Vereinigten Königreich, der sich mit Peptidantibiotika befasst, sagte, der eigentliche Engpass bei der Suche nach neuen Antibiotika sei nicht unbedingt der Mangel an vielversprechenden Verbindungen, sondern die Tatsache, dass die Pharmaunternehmen potenzielle Peptidantibiotika entwickeln und klinisch testen müssten, da diese instabil und schwer zu synthetisieren seien. Er war nicht an der Forschung beteiligt.
"Ich sehe keinen unmittelbaren Grund, Paläo-Proteome zu untersuchen. Wir haben bereits ... eine Menge dieser Peptide", sagte er. "Was wir meiner Meinung nach wirklich brauchen, ist ein tiefes Verständnis der zugrundeliegenden ... Prinzipien: was das Peptid bioaktiv macht, um es entwerfen zu können."
"Es gibt viele dieser Peptid-Antibiotika, die von der Industrie aufgrund von Schwierigkeiten wie Toxizität nicht entwickelt und weiterverfolgt wurden", sagte Ghilarov.
Laut einer im Mai 2021 veröffentlichten Studie haben von 10.000 vielversprechenden Verbindungen, die von Forschern identifiziert wurden, nur ein oder zwei Antibiotika die Zulassung der US Food and Drug Administration erreicht.
Dr. Monique van Hoek, Professorin und stellvertretende Forschungsleiterin an der School of Systems Biology der George Mason University in Fairfax, Virginia, sagte, die Idee der molekularen De-Extinktion sei ein wirklich interessanter Ansatz". Sie war an keiner der beiden Studien beteiligt.
Van Hoek sagte, dass es selten vorkomme, dass ein in der Natur gefundenes Peptid - sei es ein ausgestorbenes oder ein von einem lebenden Organismus stammendes - direkt zu einer neuen Art von Antibiotikum oder einem anderen Medikament führe. Häufiger sei es so, dass die Entdeckung eines neuen Peptids einen Ausgangspunkt für Forscher biete, die dann mit Hilfe von Computertechniken das Potenzial des Peptids als Wirkstoffkandidat ausloten und optimieren könnten.
Van Hoeks Forschung konzentriert sich derzeit auf ein synthetisches Peptid, das von einem Peptid inspiriert wurde, das in der Natur des amerikanischen Alligators vorkommt. Das Peptid befindet sich derzeit in der präklinischen Testphase.
"Bis jetzt läuft es wirklich gut. Und das ist aufregend, denn viele andere Peptide, an denen ich im Laufe der Jahre gearbeitet habe, sind aus dem einen oder anderen Grund gescheitert", sagte sie.
Van Hoek sagte, dass es zwar verrückt erscheinen mag, Alligatoren oder ausgestorbene Menschen als neue Quelle für Antibiotika zu betrachten, aber angesichts des Ausmaßes der Krise lohnt sich dieser Ansatz.
De la Fuente stimmte dem zu. "Ich denke, wir brauchen so viele neue und unterschiedliche Ansätze wie möglich, um unsere Chancen auf Erfolg zu erhöhen", sagte er.
"Ich denke, wir können viele potenziell nützliche Lösungen finden, wenn wir hinter uns schauen.
Lesen Sie auch:
Quelle: edition.cnn.com







