FDA on track to approve first CRISPR gene-editing therapy, bringing hope to thousands of sickle cell anemia patients
„Ich hatte Angst, dass ich Superkräfte bekommen könnte“, sagte Johnny, jetzt 15, der in Trumbull, Connecticut, etwa 60 Meilen nördlich von New York City, lebt.
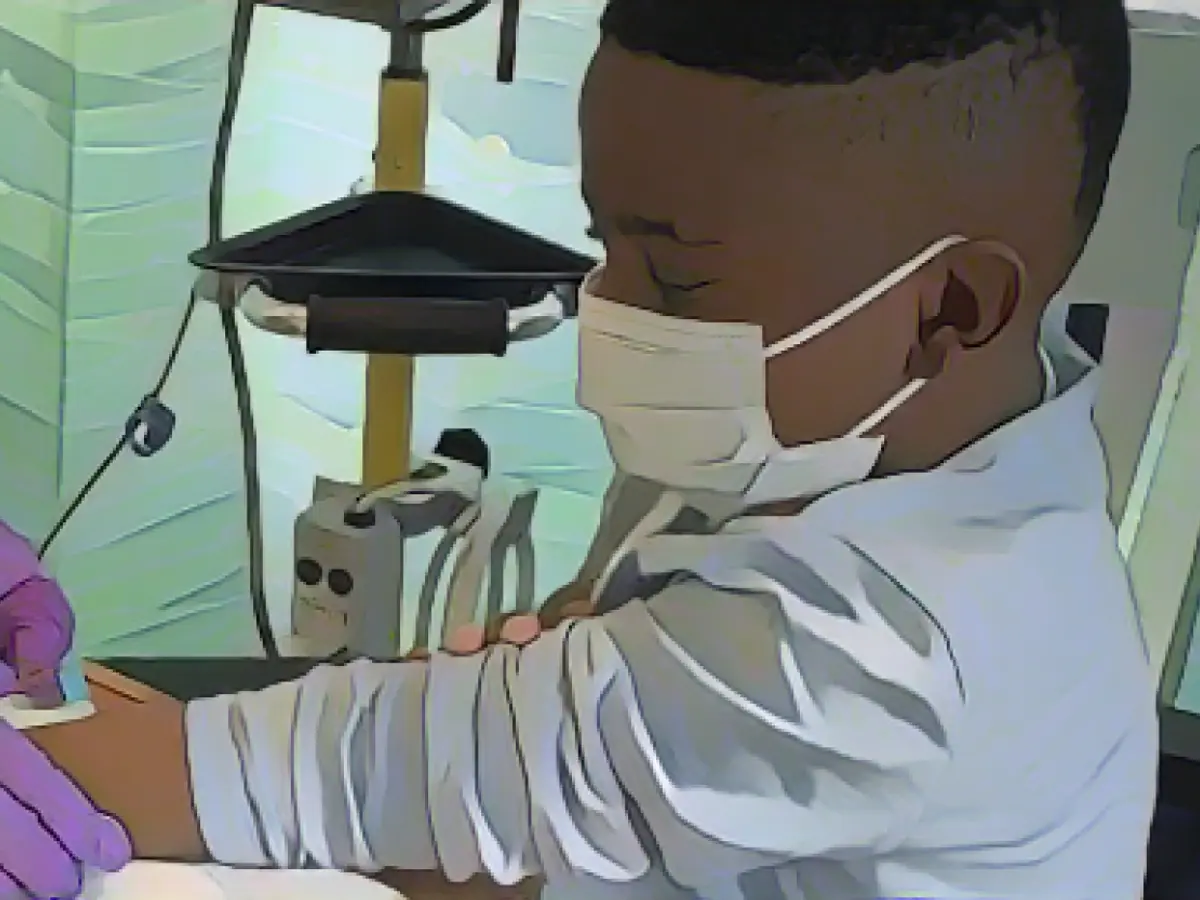
Johnny ist einer von schätzungsweise 100.000 Sichelzellenpatienten in den Vereinigten Staaten und einer der ersten weltweit, der eine neue Klasse von Medikamenten ausprobiert: eine, die ein Gen-Editing-Tool namens CRISPR verwendet, um eine mögliche Behandlung anzubieten.
Die Behandlung mit dem Namen Exa-Cel wird von Vertex Pharmaceuticals und Crispr Therapeutics hergestellt und wird voraussichtlich heute von der US-amerikanischen Food and Drug Administration zugelassen.
Für viele in der Sichelzellanämie-Community hat dies lange auf sich warten lassen. Nach Angaben der Centers for Disease Control and Prevention sind schätzungsweise 1 von 365 geborenen schwarzen Babys von der Krankheit betroffen, die vor allem Afroamerikaner betrifft. Es wurde lange angenommen, dass sie von der Pharmaindustrie ausgenutzt wird Ignorieren. Man geht davon aus, dass etwa 20.000 Menschen in den Vereinigten Staaten an einer Krankheit leiden, die schwerwiegend genug ist, um für eine solche Behandlung in Frage zu kommen.
Die erste „molekulare Krankheit“
Die Grundlagen der Sichelzellenanämie sind seit fast einem Dreivierteljahrhundert bekannt. Die Krankheit wurde 1949 bekannt gegeben, als der Chemiker Linus Pauling in Science einen Artikel veröffentlichte, in dem er beschrieb, wie sich das sauerstofftransportierende Protein Hämoglobin bei Sichelzellenpatienten unterscheidet. Es handelt sich um die erste „molekulare Krankheit“. Das war vier Jahre bevor die berühmte Doppelhelixstruktur der DNA vorgeschlagen wurde.
„Wir haben darauf gewartet, seit die DNA zum ersten Mal entdeckt wurde“, sagte Dr. Lewis Hsu, Chefarzt der American Sickle Cell Association und Arzt, der Kinder mit Sichelzellenanämie behandelt. „Es ist lange, lange her.“
Die Sichelzellenanämie wird durch eine genetische Mutation verursacht, die dazu führt, dass rote Blutkörperchen, die Hämoglobin enthalten und Sauerstoff durch den Körper transportieren, deformiert werden, beispielsweise eine Halbmond- oder Sichelform. Diese missgebildeten Zellen können in Blutgefäßen stecken bleiben und Organschäden sowie das Kennzeichen der Sichelzellenanämie verursachen – schreckliche Schmerzen, die tagelang anhalten und als Schmerzkrise bezeichnet werden.
„Es fällt mir irgendwie schwer, Dinge wie Spaß zu haben, weil ich mir immer Sorgen machen muss, ob ich eine Schmerzkrise bekomme“, sagte Johnny. Der Schmerz ist hauptsächlich im unteren Rückenbereich und immer wie ein stechender Schmerz. ...sehr schmerzhaft. "
Bisher bestand die einzige Hoffnung auf Heilung für Menschen mit Sichelzellenanämie in einer Knochenmarks- oder Stammzelltransplantation. Aber Johnny konnte, wie mehr als 80 Prozent der Sichelzellenpatienten, keinen passenden Spender finden.
In den ersten 13 Jahren seines Lebens wurde Johnny alle paar Monate wegen Schmerzkrisen und Komplikationen aufgrund anderer Krankheiten ins Krankenhaus eingeliefert. Seine Eltern müssen sich mit Opioid-Schmerzmitteln eindecken und immer eine „Go-Tasche“ bei sich tragen, falls sie kurzfristig ins Krankenhaus müssen.
Aber seit Johnny im Oktober 2021 eine einmalige Infusion seiner eigenen gentechnisch veränderten Zellen erhielt, hatte er keine Krise mehr.
„Er war wie ein normales Kind“, sagte Fabienne Desir, Johnnys Mutter. „Es hat unser Leben verändert.“
Neue Tools zur Genbearbeitung
CRISPR ist eine Gen-Editing-Technologie, die es Wissenschaftlern ermöglicht, DNA präzise zu schneiden. Die erste wissenschaftliche Arbeit darüber wurde 2012 veröffentlicht, nur acht Jahre nach ihren Entwicklern – Jennifer Doudna und Emmanuelle Charpentier. Später gewann er den Nobelpreis für Chemie.
Bei der Sichelzellenanämie werden die Zellen des Patienten aus dem Körper entnommen und mithilfe von CRISPR bearbeitet, um die Produktion von fötalem Hämoglobin, einem Protein, das von Babys im Mutterleib produziert wird, wiederherzustellen. Sobald die veränderten Zellen zurückkehren, kann das fetale Hämoglobin das mutierte Hämoglobin, das die Sichelzellenanämie verursacht, kompensieren, erklärt Dr. Monica Bhatia, Leiterin der pädiatrischen Stammzelltransplantation am Irving Medical Center der NewYork-Presbyterian/Columbia University, half bei der Durchführung der Studie, an der Johnny beteiligt war.
„Wir wissen, dass fötales Hämoglobin eine höhere Sauerstofftransportkapazität hat als erwachsenes Hämoglobin oder Sichelhämoglobin“, sagte Bhatia.
Bhatia erklärte, dass die Herstellung von fötalem Hämoglobin und Sichelhämoglobin Patienten Menschen mit Sichelzellanämie ähnlich macht. Das sei der Fall, wenn jemand ein Sichelzellanämie-Gen und ein normales Gen erbte, sagte sie, und er „hat keine Komplikationen durch die Krankheit.“ „Das ist gut genug.“
In der Tat, Doktor. David Altshuler, wissenschaftlicher Leiter des Arzneimittelherstellers Vertex, stellte fest, dass manche Menschen mit einer genetischen Mutation geboren werden, die den fötalen Hämoglobinspiegel auf einem hohen Niveau hält, „und obwohl sie an der Krankheit leiden, haben sie keine Symptome.“
„Es ist also wie ein physiologischer, bewährter Ansatz, der funktioniert, wenn man fötales [Hämoglobin] einschalten kann“, sagte er.
Klinische Studienergebnisse, darunter auch die von Johannes, bestätigen dies. Von der FDA im Vorfeld einer Sitzung des Therapeutics Advisory Committee im Oktober zitierte Daten zeigten, dass 29 von 30 Patienten das Hauptziel der Studie erreichten: Schmerzfreiheit für mindestens 12 Monate nach der Behandlung. Der maximale Zeitraum ohne Krise beträgt 45 Jahre. Fünf Monate, fast vier Jahre später, werden Forscher die Patienten weiterhin beobachten.
Hoffentlich hält die Wirkung ihr ganzes Leben lang an.
„Wir haben nicht so viele Langzeitdaten wie bei Stammzelltransplantationen“, sagte Bhatia. „Aber die Hoffnung ist, dass dies mit einer Transplantation vergleichbar und nachhaltig sein wird.“
Die CRISPR-Therapie, in anderen Ländern, in denen sie zugelassen ist, als Casgevy bekannt, ist nicht die einzige neuere Behandlung von Sichelzellenanämie. Der andere, der eine andere Technologie verwendet, ist nur Wochen im Rückstand und könnte vor dem 20. Dezember genehmigt werden. Der zweite Ansatz von Bluebird Biotech basiert auf einer älteren Technologie, bei der ein Virus verwendet wird, um gesunde Kopien des Gens zu liefern, das erwachsenes Hämoglobin produziert, um das Gen zu kompensieren, das Sichelhämoglobin produziert. Dazu gehört auch die Entnahme von Zellen aus dem Körper des Patienten und deren anschließende Rückführung. Es zeigte auch ähnlich ermutigende Ergebnisse.
„Das sind enorme Vorteile für die Patienten“, sagte Andrew Obenschein, CEO von Bluebird.
Millionen-Dollar+-Preisliste
Es ist jedoch von entscheidender Bedeutung, ob sich die Menschen diese Behandlungen leisten können und darauf zugreifen können. Einmalige Gentherapien kosten oft über 1 Million US-Dollar und erfordern die Infrastruktur eines großen Gesundheitssystems.
„Ich weiß nicht, ob es gedeckt und bezahlt wird“, sagte Hsu. Er wies darauf hin, dass akademische medizinische Zentren, die Behandlungen anbieten können, häufig in Großstädten angesiedelt seien.
„Ich bin in Illinois, und sie konzentrieren sich im Wesentlichen auf Chicago, wodurch der Rest des Staates leer bleibt, sodass die Menschen große Entfernungen zurücklegen müssen, um hierher zu gelangen“, sagte er. „Und dann gibt es Staaten, die nichts haben.“
Die Behandlung ist nicht einfach; sie erfordert viel zusätzliche Pflege, was die Kosten erhöht. Patienten bleiben in der Regel etwa einen Monat im Krankenhaus, um sich auf die Reinfusion von gentechnisch veränderten Zellen vorzubereiten. Sie unterziehen sich zunächst einer sogenannten „Konditionierung“: einer mehrtägigen Chemotherapie, um ihr Knochenmark zu zerstören, das Blutzellen und Blutplättchen produziert, damit sie bereit sind Gut für die Aufnahme neuer Zellen.
Dann „dauert es eine Weile, bis diese Zellen das Knochenmark besiedeln und wachsen“, sagte Bhatia.
Die Zeit vor und nach einer Infusion kann für Patienten und ihre Familien sehr schwierig sein; Johnnys Mutter beschrieb Johnnys „ganzen Magen-Darm-Trakt, der entzündet war; er konnte nicht schlucken. Es war wirklich schmerzhaft.“ Es war hässlich. "
Xu wies darauf hin, dass Chemotherapie-Behandlungen Risiken bergen, einschließlich der Möglichkeit einer Unfruchtbarkeit. Er wies darauf hin, dass es Möglichkeiten gibt, die Fruchtbarkeit vor der Behandlung zu erhalten, die Deckung jedoch auch je nach Bundesstaat unterschiedlich sein kann. Laut der Interessenvertretung Sick Cells verlassen sich mehr als die Hälfte der Sichelzellenpatienten in den USA auf Medicaid als Erstversicherung.
Konditionierungsbehandlungen bergen auch potenzielle Krebsrisiken; zwei Patienten in den frühen Stadien der Bluebird-Studie starben, nachdem sie an Leukämie erkrankt waren, was wahrscheinlich nicht mit der Gentherapie selbst zusammenhängt, wohl aber mit der Vorbereitung darauf .im Zusammenhang mit der erforderlichen Chemotherapie.
Altshuler von Vertex sagte, sein Unternehmen arbeite daran, den Konditionierungsprozess zu verbessern, um ihn sanfter zu gestalten und „die Möglichkeit zu schaffen, dass neue Zellen eindringen, ohne dem Körper weitere Schäden zuzufügen“, obwohl er anmerkte, dass sich dies noch in der Forschungsphase befinde.
Wissenschaftler sind auch besorgt über mögliche Off-Target-Effekte der CRISPR-Gen-Editierungsmethode – was bedeutet, dass DNA an unerwarteten Stellen geschnitten werden könnte – und die FDA hielt im Oktober eine ganztägige Sitzung ab, um diese Risiken zu bewerten. Viele Experten zeigten sich zuversichtlich, dass die Risiken „relativ gering“ seien.
Für Altshuler besteht die größere Bedeutung der Zulassung von exa-cel darin, dass es einen solchen Fortschritt bei der Sichelzellenanämie darstellt und nicht darin, dass es sich um die erste CRISPR-Therapie handelt.
„Wir sind kein Werkzeug; wir sind ein Werkzeug.“ „Die Krankheit liegt uns am Herzen“, sagte Altshuler. „Sobald wir eine Lösung gefunden haben und nun gezeigt haben, dass man diese Krankheit sehr effektiv behandeln kann, wenn man das fötale [Hämoglobin] erhöhen kann, werden wir weiter daran arbeiten.“
Altshuler sagte, das Unternehmen befinde sich in einem frühen Stadium der Untersuchung, wie Medikamente zur Erhöhung des fötalen Hämoglobins eingesetzt werden könnten, sodass Patienten keine Konditionierungs- und Gen-Editing-Prozesse durchlaufen müssten.
Erhalten Sie den wöchentlichen Newsletter von CNN Health ###
Registrieren Sie sich hier, um Ergebnisse mit Dr. zu erhalten. Sanjay Gupta Jeden Dienstag vom CNN Health-Team.
Er merkte an, dass es noch am Anfang stünde, sagte aber, dass dieser Ansatz eine „sehr wirksame“ Antwort auf die Frage sein könnte: „Wie können wir Menschen auf der ganzen Welt mit dieser Therapie helfen?“
Die meisten Sichelzellenpatienten leben in Afrika und Indien, und Obenshain von Bluebird sagte, das Unternehmen habe keine Pläne, „diese Version“ der Gentherapie in Afrika und Indien auf den Markt zu bringen, da die Herstellungskosten zu hoch wären. „Grundsätzlich produzieren wir für jeden Patienten eine Medikamentencharge“, sagte Obenschein. Für Johnny und seine Familie waren die Auswirkungen seiner Behandlung so transformativ, dass sie nun den Tag, an dem er eine Infusion gentechnisch veränderter Zellen erhielt, als seinen zweiten Geburtstag feiern. Seine Familie sagte, er könne ohne Angst schwimmen – eine Aktivität, die zuvor eine garantierte Schmerzkrise darstellte – und verbrachte den letzten Sommer im Schwimmbad.
Obwohl er nicht die befürchteten Superkräfte erlangt, erhält er doch etwas, das vielleicht besser ist: die Chance, ein normales Kind zu sein.
„Ich habe angefangen, ihm das Autofahren beizubringen“, sagte JR Lubin, Johnnys Vater. „Wir geraten also in die üblichen Sorgen, einen Teenager großzuziehen.“

Read also:
- 80 percent of young Germans eat sustainably
- Syphilis cases in babies are increasing dramatically
- Syphilis cases in babies are increasing dramatically
- Corona or flu epidemic? These pathogens are making us cough and sniffle right now
First sentence: The Nobel Prize for Chemistry was awarded to Jennifer Doudna and Emmanuelle Charpentier for their work on CRISPR, the gene-editing tool that is used in the new therapy for sickle cell anemia.
Second sentence: Despite the high cost of the CRISPR therapy, many sickle cell anemia patients hope that it will become more widely available, allowing them to access this potentially life-changing treatment.
Source: edition.cnn.com